Настольная книга учителя по химии 9 класс - поурочные разработки
Подгруппа азота - Урок 2 - Ответы - Формирование приемов умственной деятельности у учащихся в курсе химии 9 класса - Приложения
1. а) Символы элементов главной подгруппы V группы: N, Р;
б) состав атомных частиц, соответствующих элементам главной подгруппы V группы: 7р, 7n, 7ē; 15р, 16n, 15ē;
в) электронные схемы, соответствующие атомам химических элементов главной подгруппы V группы:
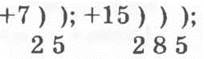
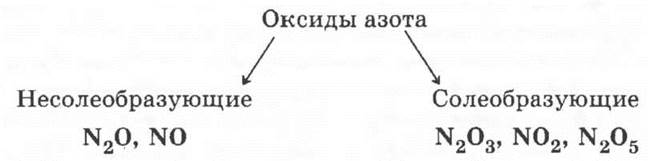
г) высшие оксиды элементов главной подгруппы V группы: N2O5, As2O5;
д) летучие водородные соединения элементов главной подгруппы V группы: NH3, РН3.
2. Bi, Sb, As, Р, N.
В указанной последовательности радиус атома уменьшается, ЭО увеличивается, окислительные свойства увеличиваются, неметаллические свойства увеличиваются.
3. NH3 — аммиак, N2 — азот, N2O — оксид азота (I), NO — оксид азота (II), HNO2 — азотистая кислота, NO2 — оксид азота (IV), KNO3 — нитрат калия.
4. Круг 1: 6Li + N2 = 2Li3N; 3Mg + N2 = Mg3N2.
Круг 2: 2![]()
Область пересечения: ![]()
7. Круг 1: NO3-, N02-. Круг 2: Na+, K+, Cu2+.
Область пересечения: NH4+ — ион аммония.
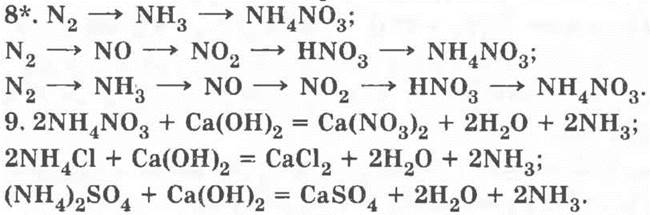
10*. а) Круг 1: NH4Cl = NH3 + HCl; NH4HCO3 = NH3 + H2O + CO2.
Круг 2: CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl;
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl.
Область пересечения 1: NH4Cl + AgNO3 = NH4NO3 + AgCl;
(NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4.
Область пересечения 2:
2NH4NO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O + 2NH3;
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3.
12. а) Азот — наполнение электрических ламп — химическая инертность;
б) аммиак — применяется в холодильных установках — легко сжижается;
в) хлорид аммония — используют при паянии — очищает поверхность металла от оксидной пленки;
г) азот — синтез аммиака — взаимодействие с водородом;
д) аммиак — получение азотных удобрений — взаимодействует с кислотами.
13.
14*. Круг 1: N2O5 — оксид азота (V), HNO3 — азотная кислота, Ca(NO3)2 — нитрат кальция.
Круг 2: NH3— аммиак, NH3 · Н2O — гидрат аммиака, NH4HCO3 — гидрокарбонат аммония.
Область пересечения: NH4NO3 — нитрат аммония.
15*. а) Реакции соединения, в которых участвуют вещества, содержащие азот: N2O5 + Н2O = 2HNO3; N2 + O2 ![]() 2NO;
2NO;
б) реакции разложения, в которых участвуют вещества, содержащие азот: NH4HCO3 = HN3 + Н2O + СO2; 2KNO3 = 2KNO2 + O2;
в) реакции обмена, в которых участвует азотная кислота:
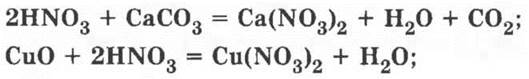
г) реакции взаимодействия азотной кислоты с металлами:
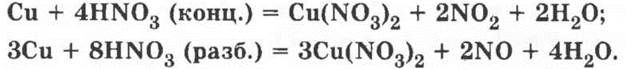
16*. При хранении на свету желтеет, разлагается с выделением кислорода, металлы не вытесняют из азотной кислоты водород, при взаимодействии концентрированной HNO3 с белками образуются вещества ярко-желтого цвета и др.
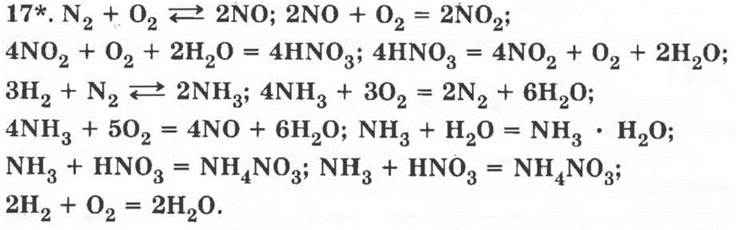
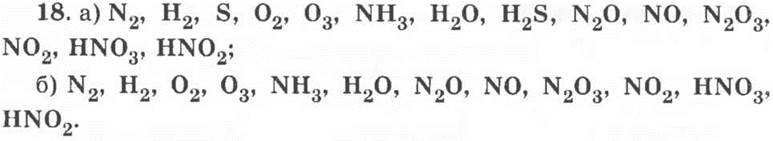
19*. Признаки, по которым можно объединять записанные вещества в группы: состав, агрегатное состояние, цвет, определенные химические свойства, нахождение в природе и т. п.
20*. Способ решения 1.
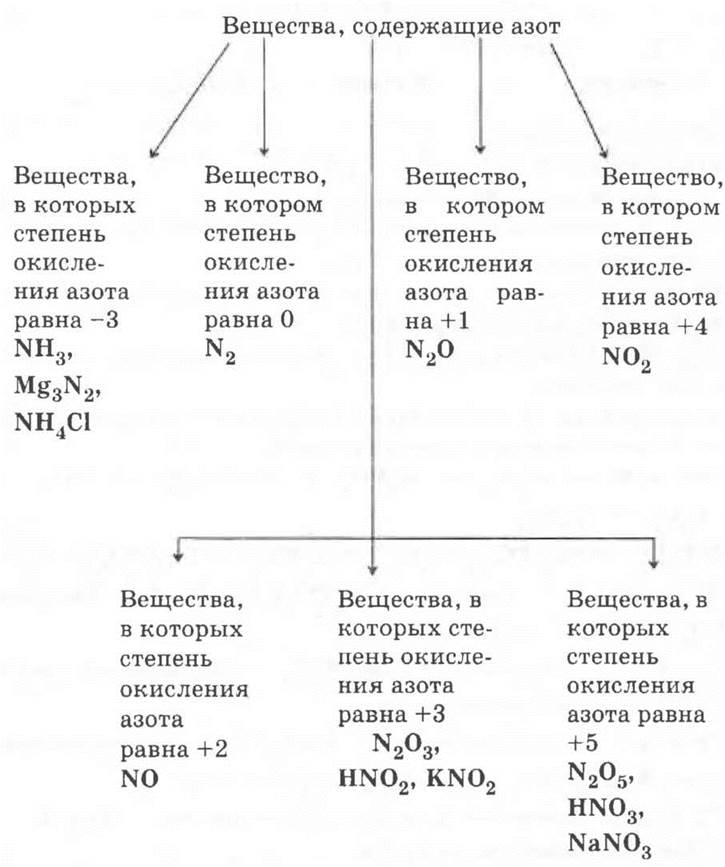
Способ решения 2.
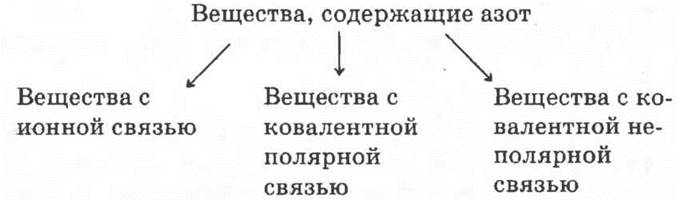
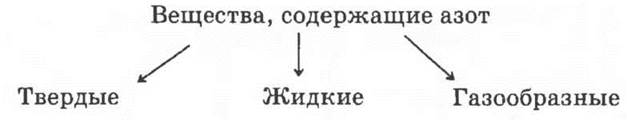
Способ решения 3.
21. Для обозначения:
а) химического элемента — 7 раз;
б) простого вещества — 4 раза.
22. О физических явлениях — 1 раз. Задание: 12.
О химических явлениях — 9 раз.
23. а) 3ē (элемент — число электронов, которых не хватает до завершения внешнего уровня);
б) фосфат кальция (элемент — сложное вещество, содержащее этот элемент);
в) растворение в сероуглероде (вещество — физическое явление, которое может с ним произойти).
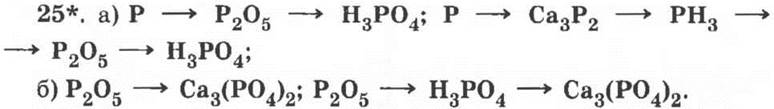
26. Группа 1 — фосфаты: Са3(РO4)2 — фосфат кальция, К3РО4 — фосфат калия.
Группа 2 — гидрофосфаты: К2НРO4 — гидрофосфат калия, MgHPO4 — гидрофосфат магния.
Группа 3 — дигидрофосфаты: NaH2PO4 — дигидрофосфат натрия, Mg(H2PO4)2 — дигидрофосфат магния.
27. Для обозначения: а) химического элемента — 3 раза;
б) простого вещества — 2 раза.