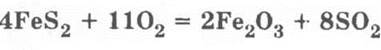Настольная книга учителя по химии 9 класс - поурочные разработки
Оксиды серы - Неметаллы
Цели урока. На примере оксидов серы конкретизировать общие свойства кислотных оксидов. Повторить на примере реакции получения оксида серы (VI) из оксида серы (IV) и кислорода обратимость химических реакций и способы смещения химического равновесия. Закрепить знания учащихся об окислительно-восстановительных реакциях на примере оксида серы (IV).
Оборудование и реактивы. Na2SО3 или NaHSО3 (крист.), НСl или H2SO4 (2:1), раствор фуксина, цветки бальзамина или герани, NaOH (раствор или гранулы), лакмус. Колба с пробкой и газоотводной трубкой, вата, пробирки, резиновая трубка с зажимом, кристаллизатор.
I. Оксид серы (IV) — сернистый газ
Демонстрация получения оксида серы (IV) проводится учителем с помощью простейшей установки (рис. 22).
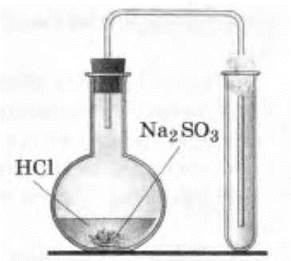
Рис. 22. Прибор для получения сернистого газа
В колбу насыпают немного (только чтобы покрыть дно) сульфита или гидросульфита натрия или калия и приливают 3—4 мл раствора серной (1 : 2) или соляной кислот. Колбу быстро закрывают пробкой с газоотводной трубкой и опускают конец ее в сухую пробирку. Отверстие пробирки закрывают комочком ваты.
Следующий этап урока посвящен рассмотрению свойств оксида серы (IV).
1. Обесцвечивание фуксина. Через минуту после сбора SO2 в сухую пробирку осторожно и медленно вынимают из нее кончик газоотводной трубки и опускают его в пробирку со слабым раствором фуксина (на 1/4) — наблюдается его обесцвечивание.
Учитель может показать и другую модификацию этого опыта. Кончик газоотводной трубки опускают в другую колбу, в которую помещается несколько влажных розовых цветков бальзамина или герани. Горлышко колбы опять закрывают комочком ваты. Через некоторое время цветы становятся белыми.
2. Взаимодействие оксида серы (IV) с водой. Пробирку с собранным сернистым газом закрывают пальцем, предварительно удалив ватную пробку, и опрокидывают ее в кристаллизатор с водой, отнимают палец и наблюдают, как постепенно пробирка заполняется водой из-за растворения SO2. Зажав снова отверстие пробирки пальцем, ее вынимают из кристаллизатора и переворачивают. Раствор сернистой кислоты разливают на три пробирки: в первую приливают лакмус — он краснеет; во вторую и третью — бромной и йодной воды, раствор мутнеет из-за образовавшейся в результате реакции серы, а бромная и йодная вода обесцвечиваются. Уравнения соответствующих реакций:
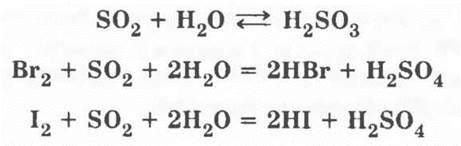
Разбираются окислительно-восстановительные реакции.
Можно показать другую, более эффектную модификацию этого опыта — своеобразный мостик к рассмотрению качественной реакции на сульфат-ион.
Во 2-ю и 3-ю пробирки приливают небольшое количество раствора ВаСl2. Если сернистая кислота была совершенно чистой, то не образуется никакого осадка. Затем в эти пробирки приливают бромную и йодную воду. Она обесцвечивается, и выпадает белый осадок BaSO4:
![]()
Кстати, расскажем, как готовится йодная вода. В пробирку нужно положить два кристаллика йода, прилить 10—15 мл воды и осторожно нагреть. Все!
Если подогреть содержимое первой пробирки — раствор сернистой кислоты, окрашенный лакмусом в красный цвет, — то окраска снова станет фиолетовой, так как кислота разложится:
![]()
3. Взаимодействие оксида серы (IV) со щелочью. Снова заправляют прибор для получения сернистого газа, добавив в него реактивы. Собирают сернистый газ в чистую сухую колбу, а затем приливают туда раствор едкого натра (можно добавить и немного твердой щелочи). Быстро закрывают колбу пробкой со стеклянной газоотводной трубкой, на конец которой надета резиновая трубка с зажимом (рис. 23). Содержимое колбы несколько раз встряхивают, кончик газоотводной трубки опускают в кристаллизатор с водой и зажим открывают. В колбе из-за реакции между SО2 и NaOH
![]()
образовалось разреженное пространство, и вода из кристаллизатора начинает поступать в колбу.
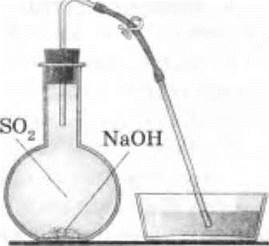
Рис. 23. Прибор для демонстрации взаимодействия сернистого газа с едким натром
В заключение этой части урока учитель просит ребят определить, какие свойства будут более характерны для SО2: окислительные или восстановительные. Ребята верно решают, что и те и другие, так как сера имеет в этом соединении не крайние степени окисления, а промежуточные:
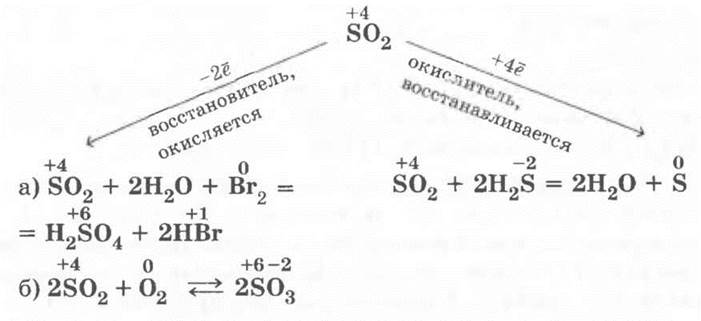
4. Взаимодействие оксида серы (IV) с сероводородом. Эту реакцию учитель демонстрирует, сливая растворы сернистого газа и сероводорода — содержимое пробирки мутнеет из-за образовавшейся серы. Кстати, многие ученые считают, что вулканическая сера — продукт именно такой реакции.
5. Окисление оксида серы (IV) в оксид серы (VI). Можно рассмотреть пятое свойство сернистого газа. У учителя появляется благодатный материал для повторения и закрепления знаний учащихся о химической реакции и химическом равновесии.
Вначале ребята самостоятельно характеризуют эту реакцию по всем известным им признакам классификаций химических реакций:

Это реакция:
• соединения, так как из простого и сложного вещества образуется одно сложное вещество;
• гомогенная, так как все вещества, участвующие в ней в условиях проведения, являются газами. (Учитель должен подчеркнуть, что SО3 — это бесцветная жидкость, затвердевающая при температуре ниже 17 °С в белую твердую кристаллическую массу, однако в условиях данной реакции является газообразным веществом.);
• каталитическая, так как используется катализатор, например V2О5;
• экзотермическая, так как протекает с выделением теплоты;
• окислительно-восстановительная (SО2 — восстановитель, а О2 — окислитель);
• обратимая.
Затем повторяют принцип Лe Шателье и рассматривают условия смещения равновесия вправо:
• [SО2] и [О2] — увеличить, a [SО3] — уменьшить;
• давление необходимо увеличить, так как в прямой и обратной реакциях участвуют газы в мольном отношении 3:2;
• температуру нужно понизить, но тогда по правилу Вант-Гоффа резко упадет скорость процесса. Поэтому выбирают оптимальные для реакции значения температуры: от 430 до 490 °С.
Нелишне будет вспомнить, что катализатор на равновесие не влияет: он в равной степени ускоряет как прямую, так и обратную реакции.
II. Оксид серы (VI)
Ребята сами характеризуют свойства S03 как кислотного оксида, приводя уравнения соответствующих реакций.
III. Получение SО2 в промышленности (эта часть урока является «мостиком» к следующему уроку)
В качестве исходного сырья для получения S02, S03 и, как конечной цели, — H2S04 используют природные соединения серы: серу, сероводород и серный колчедан.
На этом уроке рассматривается только 1-я стадия получения серной кислоты — получение сернистого газа — и разбираются окислительно-восстановительные процессы:

и с коэффициентами:
![]()
Для обжига колчедана:
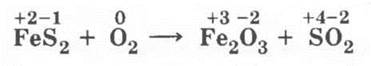
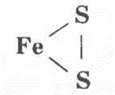
Здесь необходимо подчеркнуть, что в колчедане между атомами серы имеется ковалентная неполярная связь:
Учитель предлагает ребятам запомнить несложное правило для определения коэффициентов для таких окислительно-восстановительных реакций, в которых изменяют свои степени окисления не два, как обычно, химических элемента, а сразу три: для составления баланса учитывают число атомов каждого из этих элементов для правой части будущего уравнения:

и с коэффициентами:
![]()
Кстати, слабые учащиеся, для которых ОВР представляют ся сложным материалом, с удовольствием уравнивают эти схе мы обычным путем, пользуясь дробными коэффициентами:
![]()
и, далее: ![]()
![]()
и, далее: