Настольная книга учителя по химии 9 класс - поурочные разработки
Халькогены. Сера - Неметаллы
Цели урока. Дать общую характеристику халькогенов. Охарактеризовать серу в свете трех форм существования этого химического элемента: в форме атомов, простых веществ, а следовательно, и аллотропию ее, а также в форме некоторых соединений серы. Химические свойства серы как простого вещества рассмотреть в свете окислительно-восстановительных реакций.
Оборудование и реактивы. Руды и минералы: красный, бурый и магнитный железняки, колчедан, цинковая обманка, свинцовый блеск, киноварь, глауберова соль, гипс, алебастр. Сера, толуол, Na, Fe (порошок), Zn (пыль), Zn (гранулы), Аl (порошок), тоненькая медная проволока, НСl, КМnO4, КСlO3. Пробирки, стаканчик, штатив, горелка, спички, колба с обратным холодильником, лупа, часовое стекло, ступки с пестиками, фарфоровые тигли, прибор для получения газов.
I. Общая характеристика халькогенов
Учитель просит учащихся дать известные им общие названия подгрупп химических элементов и объяснить их этимологию:
• благородные или инертные газы;
• щелочные металлы;
• щелочноземельные металлы;
• галогены.
Общее название элементов главной подгруппы VI группы — «халькогены» в переводе с греческого обозначает «рождающие руды». А ведь и в самом деле основные руды, используемые в металлургической промышленности, представляют собой соединения родоначальников подгруппы — кислорода — оксиды:
а) красный железняк (гематит) — Fe2O3;
б) бурый железняк (лимонит) — Fe2O3 · nН2O;
в) магнитный железняк (магнетит) — Fe3O4; и серы — сульфиды:
а) серный колчедан (пирит) — FeS2;
б) медный колчедан — CuFeS3;
в) цинковая обманка — ZnS;
г) свинцовый блеск — PbS и т. д.
Атомы этих элементов содержат на внешнем уровне 6 электронов и отсюда

Учащиеся сами определяют, что кислород только по отношению ко фтору будет проявлять восстановительные свойства, получая при этом с. о. +2 или +1, во всех остальных случаях он будет проявлять окислительные свойства, получая в результате с. о. -2 (-1 в пероксидах Н2O2, Na2O2).
II. Простые вещества, образованные серой
Многообразие простых веществ, образованных халькогенами, определяется способностью этих элементов к аллотропии. Аллотропию кислорода, напоминает учитель, мы рассмотрели в теме «Общие свойства неметаллов» и просит учащихся назвать причины аллотропии для этого элемента. А вот для серы причина аллотропии заключается в разном строении кристаллов ее модификаций.
Учитель просит вспомнить из начала курса 9 класса, какие модификации серы ребята знают. Если ученики затрудняются, то он указывает, что наиболее известны три аллотропных видоизменения серы:
• сера ромбическая;
• сера моноклинная;
• сера пластическая.
Демонстрация получения пластической серы. В пробирку на 1/2 ее объема насыпают серы, закрепляют в лапе штатива и подогревают, при этом происходят следующие изменения серы.
При температуре около 119 °С сера плавится и превращается в золотисто-желтую легкоподвижную жидкость.
От 119 до 250 °С сера все более буреет и утрачивает подвижность.
Около 250 °С сера приобретает красно-бурую окраску и становится настолько вязкой, что не выливается из перевернутой пробирки или тигля.
От 250 до 350 °С сера постепенно разжижается. Окраска ее остается темно-бурой.
Около 350 °С сера становится вновь легко подвижной; цвет ее не изменяется, при 444,5 °С сера кипит. Пары серы оранжевого цвета.
При медленном охлаждении серы эти превращения протекают в обратном порядке.
Учитель просит учащихся отметить, как с повышением температуры изменяется цвет серы и подвижность ее расплава. Когда он, покачивая пробирку, показывает, что сера загустела (около 250 °С), а затем переворачивает ее над фарфоровой чашкой, ученики смогут убедиться в том, что сера не выливается.
При дальнейшем нагревании ребята замечают, что сера начинает постепенно разжижаться и темнеть. Когда сера начнет кипеть, учитель просит обратить внимание на прозрачные оранжевые пары ее, которые хорошо видны над кипящей серой (на белом фоне). Если сера вспыхнет, то ее гасят, прикладывая плотно к горлышку пробирки кусочек картона.

Рис. 17. Получение пластической серы
Закипевшую серу выливают тоненькой струйкой в стакан с холодной водой (рис. 17). Затем ее вынимают и растягивают — образовалась пластическая сера:
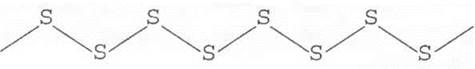
Получение моноклинной серы. В колбу наливают на 1/4 объема толуол, прибавляют 3—4 г измельченной черенковой серы, закрывают пробкой со стеклянной трубкой (обратным холодильником) (рис. 18) и нагревают, все время взбалтывая содержимое колбы. Когда сера растворится, нагревание прекращают. По мере охлаждения из раствора начинают выделяться игольчатые кристаллы моноклинной серы. Их лучше рассматривать с помощью лупы. С целью экономии времени на уроке образцы моноклинной серы можно приготовить заранее, поместить раствор серы в толуоле в кристаллизатор (перед самим уроком), образцы ее на часовом стекле вместе с лупой можно передать на столы учащимся для ознакомления (рис. 19).

Рис. 18. Колба с обратным холодильником
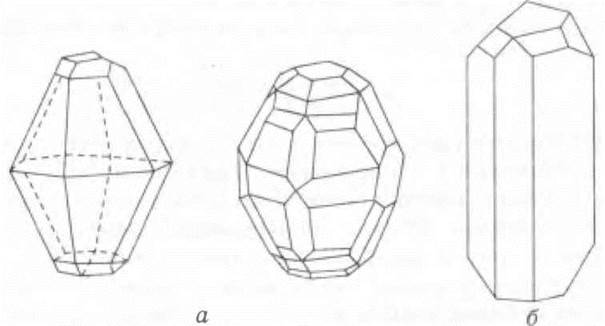
Рис. 19. Форма кристаллов серы: а — ромбической; б — моноклинной
III. Халькогеноводороды
Соединения халькогенов будут рассмотрены при дальнейшем изучении темы, поэтому учитель останавливается лишь на водородных соединениях халькогенов—халькогеноводородах: Н2O— H2S — H2Se — Н2Те, среди которых только вода — жидкость, очень слабое амфотерное соединение ![]() остальные — газы, растворы которых будут проявлять кислотные свойства. Подобно галогеноводородам, прочность молекул халькогеноводородов уменьшается, а сила кислот, наоборот, растет. Учитель просит учащихся объяснить эту закономерность.
остальные — газы, растворы которых будут проявлять кислотные свойства. Подобно галогеноводородам, прочность молекул халькогеноводородов уменьшается, а сила кислот, наоборот, растет. Учитель просит учащихся объяснить эту закономерность.
IV. Природные соединения халькогенов
1. Кислород:
• в свободном виде — O2 — входит в состав атмосферы — 21% по объему, верхние слои атмосферы содержат озон O3;
• в виде воды — в состав гидросферы (Мирового океана), которая покрывает 3/4 Земли;
• в виде соединений составляет почти половину (49% по массе) земной коры — литосферы.
2. Сера:
• самородная — ![]()
• сульфидная — ![]() (сероводород и уже названные выше руды);
(сероводород и уже названные выше руды);
• сульфатная — SO42- (гипс CaSO4 · 2Н2O, глауберова соль Na2SO4 · 10Н2O).
V. Химические свойства серы
Ученики сами прогнозируют химические свойства серы. Она взаимодействует с металлами и водородом (окислительные свойства), с кислородом и другими окислителями (восстановительные свойства).
Взаимодействие серы с металлами
Учитель демонстрирует опыты, а учащиеся самостоятельно записывают уравнения реакций и разбирают окислительно-восстановительные процессы.
1. Взаимодействие серы с натрием проводится в фарфоровой ступке по аналогии реакции натрия с йодом:
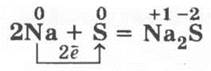
2. Взаимодействие серы с железом можно провести в двух вариантах. Учитель смешивает в фарфоровой чашечке 4 г порошка серы и 7 г порошка железа (его лучше купить в аптеке, так как оно чистое и свежевосстановленное — применяется для лечения малокровия). Смесь делят на две части, которые помещают в два фарфоровых тигля (можно для наглядности и использовать закрепленные в лапках штативов пробирки). Если прикоснуться раскаленной проволокой или тлеющей (горящей) лучинкой к смеси в первом тигле (пробирке), то начнется энергичная реакция, в результате которой получается вещество черного цвета — сульфид железа (II). Во вторую пробирку (тигель) приливают три капли воды с помощью длинной пипетки и перемешивают смесь. Идет аналогичная реакция. Здесь вода сыграла роль катализатора:
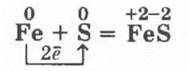
3. Взаимодействие цинковой пыли с порошком серы (в массовом соотношении 1:2) проводится аналогично: при поджигании одной половины смеси и с помощью катализатора — воды — для другой половины. Вторую модификацию опыта проводят так: помещают смесь в фарфоровую чашечку (пробирку), делают в ней углубление и вводят каплю воды. В обоих случаях происходит ослепительная вспышка и образуется белый сульфид цинка:
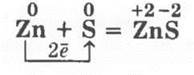
4. Взаимодействие порошка алюминия с порошком серы (в массовом отношении 1:1,5) проводится при подогревании — смесь вспыхивает ослепительным пламенем:
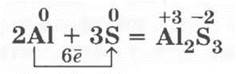
Учитель может показать также и горение пучка тоненьких медных проволочек в парах серы — при этом образуется черный сульфид меди (I) (рис. 20):
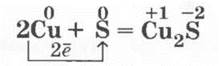
Затем следует обобщение: сера взаимодействует со всеми металлами, кроме Аи и Pt. Со ртутью она, например, взаимодействует даже при обычной температуре, что используют при обеззараживании помещений от пролитой там ртути. Процесс называется демеркуризацией (объясняется этимология этого термина).
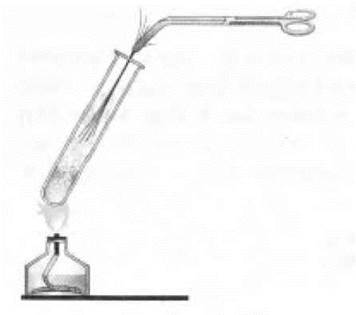
Рис. 20. Горение меди в парах серы
Взаимодействие серы с водородом
Демонстрация взаимодействия серы с водородом проводится под тягой вследствие того, что H2S сильно ядовит. Для получения медленного тока водорода можно использовать аппарат Кирюшкина (пробирочную малую модель аппарата Киппа). При пропускании водорода в пробирку, где кипит жидкая сера, у отверстия пробирки отчетливо ощущается запах H2S — тухлых яиц (рис. 21):
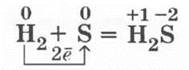
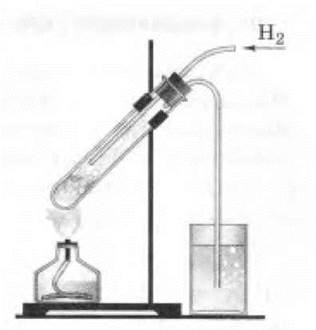
Рис 21. Синтез сероводорода и растворение его в воде
Взаимодействие серы с кислородом
Восстановительные свойства серы учитель демонстрирует на хорошо знакомой реакции горения серы: при поджигании на воздухе она горит голубоватым пламенем, а при внесении ложечки с горящей серой в колбу с кислородом сгорает ярко-синим пламенем, образуя бесцветный газ — оксид серы (IV):
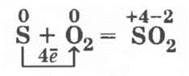
Взаимодействие серы со сложными веществами
Взаимодействие серы со сложными веществами — окислителями можно показать на эффектной реакции взаимодействия бертолетовой соли (если ее можно будет достать!) с серой. В фарфоровую чашечку втирается немного серы, а затем помещается несколько мелких кристалликов бертолетовой соли. Уже при легком растирании кристалликов раздаются взрывчики и вспыхивает пламя:
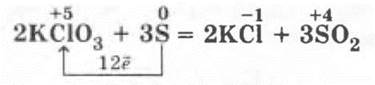
Такая реакция, в частности, подчеркивает учитель, лежит в основе «работы» спичек. В них красный фосфор и сульфид сурьмы (III) Sb2S3 с помощью клея наносится на боковую поверхность спичечного коробка, а головка спички готовится обычно из бертолетовой соли, серы, стеклянного порошка и клея.
Под действием теплоты трения мельчайшие частички красного фосфора превращаются в белый фосфор, который воспламеняется на воздухе и поджигает головку спички.
VI. Применение серы
Сера, подчеркивает учитель в заключение, — один из неметаллов, известных человеку с древнейших времен. Ее использовали для религиозных обрядов — поджигали при различных церемониях и ритуалах; ею чернили оружие, употребляли для изготовления косметики и лекарств, жгли для отбелки тканей и борьбы с насекомыми, использовали для изготовления черного пороха.
В наши дни сера не теряет, а все более увеличивает свое значение в жизни человека. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краски, удобрения и ядохимикаты — это все только небольшой перечень того, для изготовления чего необходима сера.