Физика - Поурочные планы к учебникам Г. Я. Мякишева, С. В. Громова и В. Л. Касьянова 10 класс
Изопроцессы - МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
Цель урока: рассмотреть частные случаи закона Клапейрона.
Ход урока
I. Проверка домашнего задания. Повторение изученного
1. Каковы нормальные условия для идеального газа?
2. Какова концентрация молекул идеального газа при нормальных условиях?
3. Какие макроскопические параметры связывает уравнение Клапейрона-Менделеева?
4. Какие параметры необходимо знать для определения состояния идеального газа?
II. Самостоятельная работа
Вариант 1
1. Как изменится давление идеального одноатомного газа при уменьшении его объема в 4 раза и увеличении абсолютной температуры в 2 раза?
А. Увеличится в 8 раз.
Б. Увеличится в 4 раза.
В. Увеличится в 2 раза.
Г. Не изменится.
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом 8,3 м3 при температуре 100 °С.
A. 10 Па.
Б. 830 Па.
B. 100 Па.
Г. 373 Па.
3. Как меняется масса воздуха в помещении, если температура увеличивается?
А. Уменьшается.
Б. Увеличивается.
В. Не изменяется.
4. Чему равен объем 1 моля идеального газа при нормальных условиях?
А. 1 м3.
Б. 24 м3
В. 0,024 м3.
5. В баллоне находится газ при t = 27 °С. Во сколько раз уменьшится давление газа, если 50 % его выйдет из баллона, а температура при этом увеличится до 600 К?
6. Масса кислорода m при давлении Р занимает объем V. Как изменится температура газа, если при увеличении давления до 2Р его объем уменьшился в V/10?
A. Увеличится в 5 раз.
Б. Уменьшится в 5 раз.
B. Не изменится.
7. В баллоне при неизменной массе газа температура увеличилась от 1 до 2 °С. Как изменилось давление?
A. Увеличилось в 2 раза.
Б. Увеличилось в 1,004 раза.
B. Не изменилось.
8. Что и по каким физическим величинам можно вычислить на основании уравнения Менделеева-Клапейрона?
1. Плотность газа, используя R, р, Т, М.
2. Число молекул в газе, используя V, Т, Р, с.
3. Массу молекулы, используя Т, Р, с, NA, R.
А. 1,2,3.
Б. 1,2.
В. 1,3
Вариант .
1. Как изменится давление идеального одноатомного газа при увеличении его объема и температуры в 2 раза?
A. Увеличится в 4 раза.
Б. Уменьшится в 2 раза.
B. Останется прежним.
2. Вычислите давление водорода массой 0,02 кг в сосуде объемом 8,3 м3 при температуре 100 °С.
A. 3730 Па.
Б. 373 Па.
B. 1000 Па.
3. Как изменится плотность воздуха в помещении, если температура уменьшится?
A. Не изменится.
Б. Уменьшится.
B. Увеличится.
4. Чему равны давление и температура газа при нормальных условиях?
A. р = 105 Па·t – 100 °С 1 м3.
Б. р = 105 Па·Т - 273 К.
B. р = 105 кПа·T - 273 К.
5. В баллоне находится газ при Т = 300 К. Во сколько раз уменьшится давление газа, если 50 % его выйдет из баллона, а температура останется неизменной?
A. Уменьшится в 50 раз.
Б. Уменьшится в 2 раза.
B. Увеличится в 2 раза.
6. При нормальных условиях плотность кислорода:
A. Больше плотности водорода.
Б. Меньше плотности водорода.
B. Равна плотности водорода.
7. При повышении температуры в комнате меняется:
A. Давление.
Б. Давление и масса воздуха.
B. Масса воздуха.
8. В цилиндре с поршнем произошло увеличение давления газа больше допустимого за счет увеличения температуры. Как можно установить прежнее давление?
A. Увеличением объема цилиндра или уменьшением массы газа.
Б. Только уменьшением массы газа.
B. Только увеличением объема цилиндра.
Ответы к самостоятельной работе
|
|
Ответы и номера вопросов |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
Вариант 1 |
А |
Г |
А |
В |
А |
Б |
Б |
В |
|
Вариант 2 |
В |
А |
В |
Б |
Б |
А |
В |
А |
III. Изучение нового материала
Если одновременно меняются все характеристики состояния газа, то трудно установить какие-либо закономерности. Прошу изучить процессы, в которых масса и один из трех параметров - р, V или Т остаются неизменными.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
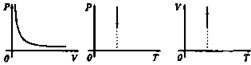
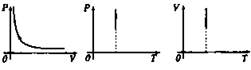
Первый газовый закон был открыт английским ученым Р. Бойлем (1627- 1691 гг.) в 1600 г. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля-Мариотга.
PV = const.
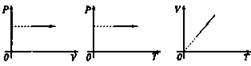
Закон Гей-Люссака (1802 г.)
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Объем данной массы газа при p = const зависит от температуры по лин. закону ![]()
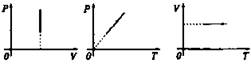
Изохорический процесс
Закон Ж. Шарля (1787 г)
При V = const давление данной массы газа при постоянном объеме зависит от температуры по линейному закону: ![]()
Фронтальное экспериментальное задание 1
«Наблюдение зависимости объема данной массы газа от температуры при постоянном давлении»
Приборы и материалы: 1) пробирка химическая, закрытая пробкой со стеклянной трубной длиной 150-200 мм, диаметром 4-5 мм; 2) стакан низкий с водой.
Ход работы
1. Подготовьте оборудование для опыта. Для этого опустите конец трубки с пробкой в стакан с водой на глубину 3-4 см, закройте пальцем другой конец и выньте трубку из воды. Расположите трубку горизонтально. Осторожно закройте пробирку пробкой так. чтобы столбик воды не вылился из трубки.
2. Нагрейте воздух в пробирке, подержав ее несколько секунд в руке. При этом наблюдайте за положением столбика воды в трубке.
3. Прекратите нагревание воздуха в пробирке и снова в течение нескольких секунд, наблюдайте за изменением положения столбика воды в трубке.
4. Ответьте на вопросы:
- Зависимость между какими величинами вы наблюдали на опыте?
- Изменялись ли давление и масса воздуха в пробирке во время опыта?
- Что можно сказать о зависимости объема данной массы воздуха от температуры при постоянном давлении?
Фронтальное экспериментальное задание 2
«Наблюдение зависимости давления данной массы газа от температуры при постоянном объеме»
Изопроцессы в газах
|
Название процесса |
Постоянный параметр |
Математическая запись закона |
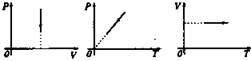
Графики процессов в системе координат p-V, p-T, V-T |
|
Изотермический |
Т = const |
pV = const |
Изотермическое расширение
Изотермическое сжатие
|
|
Изобарный |
p = const |
V/T = const |
Изобарное расширение (нагревание)
Изобарное сжатие (охлаждение)
|
|
Изохорный |
V = const |
p/T = const |
Изохорное нагревание
Изохорное охлаждение
|
Приборы и материалы: 1) пробирка химическая, закрытая пробкой с индикатором давления; 2) стакан низкий с теплой водой.
Ход работы
1. Сделайте предположение о том, как будут изменяться уровни воды в коленах индикатора давления при опускании пробирки в стакан с теплой водой.
2. Ответ проверьте на опыте.
3. Ответьте на вопросы:
- Зависимость между какими величинами вы наблюдали на опыте?
- Изменялась ли масса воздуха в пробирке во время опыта?
Примечание. Изменением объема воздуха можно пренебречь ввиду малости внутреннего диаметра стеклянной трубки индикатора давления.
- Что можно сказать о зависимости давления данной массы воздуха от температуры при постоянном объеме?
IV. Закрепление изученного
1. Что такое параметры состояния?
2. Какие величины относятся к ним?
3. Что называют изопроцессами?
4. Какой процесс называют изотермическим? изохорическим? изобарным?
V. Решение задач
1. Воздух под поршнем насоса имел давление 105 Па и объем 200 см3. При каком давлении этот воздух займет объем 130 см3, если его температура не изменится?
![]()
2. Газ занимает объем 2 м3 при температуре 273 °С. Каков будет его объем при температуре 546 °С и прежнем давлении?
![]()
3. Газ занимал объем 12,32 л. Его охладили при постоянном давлении на 45 °К, и его объем стал равен 10,52 л. Какова была первоначальная температура газа? (Ответ: Т = 308 °К.)
4. Газ находится в баллоне при температуре 288 °К и давлении 1,8 МПа. При какой температуре давление газа станет равным 1,55 МПа? Объем баллона считать неизменным. (Ответ: Т2 = 248 °К.)
5. 10 г кислорода находятся под давлением 0,303 МПа при температуре 10 °С. После нагревания при постоянном давлении кислород занял объем 10 л. Найти начальный объем и конечную температуру газа. (Ответ: V1 = 2,4 · 10-3 м3 = 2,4 л; Т2 ≈ 1,18 · 103 °К.)
Домашнее задание
П. 71, задачи на с. 182 (3-5).