Настольная книга учителя по химии 9 класс - поурочные разработки
Жиры - Органические вещества
Цели урока. Познакомить учащихся с жирами как одной из наиболее важных групп природных соединений класса сложных эфиров, с их классификацией, свойствами и значением. Дать представление о мылах и СМС. Показать пути замены жиров в технике непищевым сырьем.
Оборудование и реактивы. Этанол, бензин, растворы КМnO4, NaOH, бромная вода, спиртовка, индикаторная бумага. Демонстрационные образцы: растительное масло, кусочки твердого жира, семена подсолнечника.
I. Немного истории
Учитель просит ребят вспомнить, как был открыт трехатомный спирт глицерин (урок «Спирты»). Вскоре после открытия Шееле обнаружилось, что «масляный сахар» содержится также в сливочном масле, свином жире, во всех растительных маслах. Стало окончательно ясно, что глицерин является составной частью жира.
Интенсивные исследования жиров продолжились в первой половине XIX в. Основную роль в этих работах сыграл французский химик Мишель Эжен Шеврель. По заказу текстильной фабрики он анализировал состав мыла, изготавливаемого нагреванием отходов жиров со щелочью. Выяснилось, что оно представляет собой натриевые соли предельных одноосновных кислот с длинными углеводородными радикалами (высших кислот), например, стеариновой (учитель просит ребят «подсмотреть» в тетрадь и вспомнить формулу стеариновой кислоты). Тогда Шеврель решил изучить продукты взаимодействия со щелочами других жиров, причем не только распространенных (гусиного, говяжьего), но и экзотических: ягуарьего, тигриного. Результат оказался поразительным: любые жиры представляли собой сложные эфиры высших карбоновых кислот и трехатомного спирта глицерина! Кстати, именно Шеврель предложил изготавливать свечи из стеариновой кислоты вместо используемого в то время сала.
II. Состав и свойства жиров
После предложенного вступления ребята сами формулируют определение жиров.
Жиры — это сложные эфиры глицерина и высших карбоновых кислот.
Что значит «высшие кислоты»? Это те карбоновые кислоты, которые содержат более 10 атомов углерода в молекуле. Из
предельных кислот в состав жиров чаще всего входят пальмитиновая и стеариновая кислоты, из непредельных — олеиновая (содержит одну двойную связь в углеводородном радикале) и линолевая (две двойные связи):
C15H31СООН пальмитиновая кислота,
С17Н35СООН стеариновая кислота,
C15H35СООН олеиновая кислота,
C17H31СООН линолевая кислота.
Жиры, содержащие остатки предельных кислот, как правило, имеют животное происхождение и твердую консистенцию. Растительные жиры (или растительные масла) включают в свой состав остатки непредельных кислот, они жидкие. Как удивительно устроена природа! Жиры, встречающиеся в живых организмах, содержат остатки карбоновых кислот только с четным числом углеродных атомов и неразветвленной углеродной цепочкой.
Показать наличие жира в растительных объектах просто. Если раздавить семечку подсолнечника на листе бумаги, хорошо заметно жирное пятнышко. Подсолнечник — одна из важнейших масличных культур.
Теперь состав жиров известен. Их общая формула следующая:
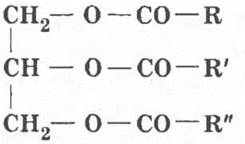
где R, R’, R’’ — различные углеводородные радикалы карбоновых кислот.
Учитель ставит перед учащимися проблемную ситуацию: предложить способ искусственного получения жира. Ключом к решению проблемы является тот факт, что жиры по химическому строению представляют собой сложные эфиры. Следовательно, получить их можно реакцией этерификации, в которую вступают глицерин и соответствующая карбоновая кислота. Катализатором реакции этерификации является сильная кислота (например, концентрированная серная). Похвалите ребят, вот так достаточно легко они повторили великое открытие, сделанное французским химиком Марселеном Бертло. Синтез жироподобных веществ, осуществленный Бертло в 1854 г., нанес окончательный удар по витализму — учению о «жизненной силе», господствовавшему в химии до середины XIX в. Приверженцы этого учения утверждали, что невозможно синтетическим путем получить вещества, вырабатываемые живыми организмами.
Учитель демонстрирует физические свойства жиров. Капли растительного масла, добавленные в пробирку с водой, плавают на поверхности: плотность жиров меньше плотности воды. При встряхивании пробирки образуется мутная эмульсия: жиры не растворяются в воде. Если в ту же пробирку добавлять этиловый спирт, то содержимое светлеет: жиры растворяются в спирте, а также в других органических растворителях (предельных углеводородах или бензине, бензоле, тетрахлорметане). Если полученный водно-спиртовый раствор жира капнуть на фильтровальную бумагу, после испарения растворителей на ней останется жирное пятно.
Из химических свойств жиров необходимо отметить самые важные.
1. Каждый слышал расхожую фразу: при физической нагрузке человек сжигает жир. Выражение образное, но не лишено химического смысла. Жиры, как и большинство органических веществ, горят. В этом легко убедиться. Учитель сооружает из фарфоровой чашки, нескольких миллилитров растительного масла и фитиля подобие лампадки и поджигает фитиль. Жир горит ярким сильно коптящим пламенем. Жиры являются одной из трех главных составляющих пищи человека и животных: при их окислении в организме выделяется энергия, необходимая для поддержания постоянной температуры тела и протекания других физиологических процессов.
2. Доказать наличие кратных С=С связей в молекулах растительных жиров можно с помощью качественных реакций. Если из-за нехватки времени учитель не демонстрировал эти опыты в теме «Непредельные углеводороды», то их можно показать на этом уроке. Несколько капель растительного масла, добавленных к растворам перманганата калия или бромной воды, вызывают их обесцвечивание. Двойная связь даже в таких сложных соединениях сохраняет свои свойства.
3. Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. По химическому составу они отличаются лишь наличием двойных углерод-углеродных связей в углеводородных радикалах жидких жиров. Учитель ставит проблемную задачу: предложить способ превращения непредельных жиров в предельные. Вспомнив свойства этиленовых углеводородов, нетрудно догадаться, что превратить непредельный углеводородный радикал в предельный можно присоединением по двойной связи молекулы водорода. Такая реакция называется реакцией гидрирования (сравнить с дегидрированием алканов). В качестве примера учитель приводит реакцию гидрирования триолеата глицерина до тристеарата.
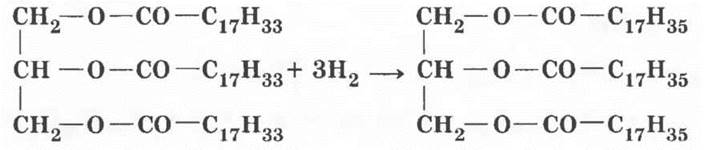
Гидрирование растительных масел — важнейший промышленный процесс. Он стал возможным благодаря работам французского химика Поля Сабатье, нашедшего катализатор этого процесса: мелкоизмельченные металлические никель или платина. За это открытие в 1912 г. Сабатье был удостоен Нобелевской премии. В результате этого процесса получается искусственный твердый жир — саломас, идущий на изготовление маргарина и заменителей сливочного масла. В жировую основу маргарина добавляют эмульгаторы, молоко, соль, сахар, ароматические вещества, сливочное масло. В кондитерской промышленности, как и в быту, маргарин идет на изготовление тортов, кремов, пирожных. Он придает тесту особый вкус и «легкость», а по калорийности не уступает натуральному коровьему маслу.
4. Одно из важнейших свойств жиров — их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если такая реакция осуществляется под действием воды в присутствии кислот, она называется гидролизом (гидро — вода, лиз — разрушение). Учащимся третьего уровня предлагается написать уравнение этой реакции на примере тристеарата глицерина (проводя подобную реакцию, Шееле открыл глицерин):
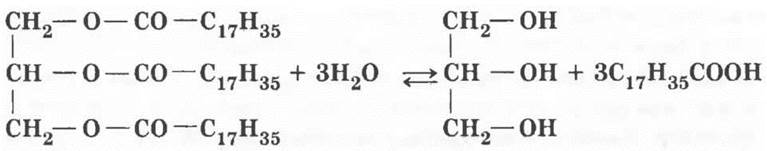
Приведенная выше реакция является обратимой. Как можно сместить равновесие вправо? Один из способов — удалить один из конечных продуктов, например превратить его в другое вещество. Если на выделяющуюся карбоновую кислоту подействовать щелочью, она превратится в соль.
![]()
Если объединить две реакции в одну, т. е. нагревать жир с раствором щелочи, то разложение будет необратимым и пройдет до конца.
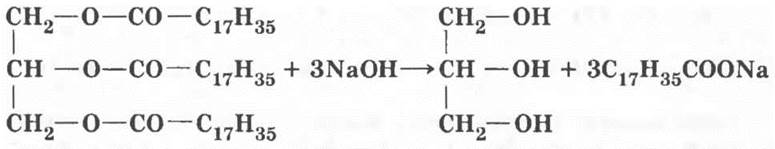
Эта реакция называется омылением, поскольку образующиеся соли щелочных металлов и высших карбоновых кислот являются мылами.
Изготовление мыла — один из самых древних химических синтезов. Правда, этот процесс моложе, чем получение этилового спирта брожением сахаров. Когда германские племена под предводительством Гая Юлия Цезаря варили козье сало с поташом (техническое название карбоната калия К2СO3), вымытым из пепла костров, они проводили ту же самую реакцию, которая осуществляется сейчас в грандиозных масштабах.
Натриевые соли высших кислот имеют твердое агрегатное состояние, а калиевые — жидкое. При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики. Однако с химической точки зрения основа любого мыла одинакова.
Растительные и животные жиры являются не только пищевыми продуктами, но и химическим сырьем. Помимо мыла, из них изготавливают смазочные материалы, жирные кислоты, глицерин, косметические средства, олифу. Однако использовать в промышленности для этих целей пищевые продукты — непозволительная роскошь и расточительство. Химики разработали процессы, позволяющие использовать для получения, например, высших карбоновых кислот парафин.
Мыла в быту и промышленности все чаще заменяются на синтетические моющие средства. Такие вещества лишены некоторых недостатков мыла: не теряют моющую способность в жесткой (в том числе морской) воде, не разъедают руки, так как не дают щелочной реакции в растворе. Вместе с тем остатки синтетических моющих средств в сточной воде очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.