Настольная книга учителя по химии 9 класс - поурочные разработки
Азотная кислота - Неметаллы
Цели урока. Повторить на примере оксидов азота классификацию и свойства оксидов, а на примере свойств азотной кислоты — общие свойства кислот в свете ТЭД. Познакомить учащихся с окислительными свойствами азотной кислоты на примере взаимодействия разбавленной и концентрированной кислоты с металлами. Дать понятие о способах получения азотной кислоты и областях ее применения.
Оборудование и реактивы. Сu (кусочки проволоки и порошок); НNO3 (разб. и конц.), скипидар, СuО; растворы NaOH, CuSO4, Na2CO3, лакмуса, фенолфталеина, индиго; кристаллическиеNaNO3, H2SO4 (конц.), снег или лед из холодильника. Прибор для получения газов, цилиндр, кристаллизатор, штатив, лучинка, горелка, спички, стакан.
I. Оксиды азота
Ученики самостоятельно записывают в столбик пять формул оксидов азота, называют их, вспоминают кислородные азотсодержащие кислоты и устанавливают соответствие между оксидами и кислотами:
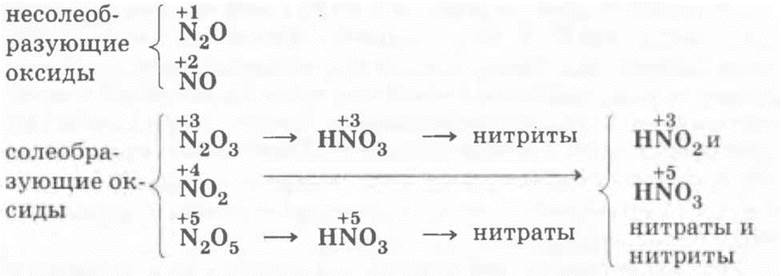
Учитель просит ребят вспомнить, какие оксиды и почему называются несолеобразующими, сообщает, что раньше такие оксиды называли также безразличными или индифферентными. Однако последнее название не совсем точно, так как такие оксиды могут быть очень даже реакционно-способными. Примером тому является уже хорошо знакомый ребятам оксид азота (II) — они вспоминают предыдущий материал: способы получения N0 (электродуговой, синтез из кислорода и азота или каталитическое окисление аммиака) и его самопроизвольное окисление в бурый оксид азота (IV):
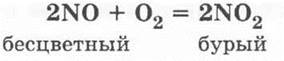
Учитель демонстрирует получение оксида азота (II) и его окисление в оксид азота (IV). Для этого в пробирку помещают немного меди и приливают на 1/4 объема ее разбавленной азотной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и после непродолжительного выделения газа (это будет воздух) кончик газоотводной трубки подводят под сосуд (цилиндр или большую пробирку) с водой. В нем собирается бесцветный газ — оксид азота (II) (рис. 32). Затем, когда сосуд заполнится NO, отверстие этого сосуда закрывают под водой стеклянной пластинкой и сосуд вынимают из воды, переворачивают отверстием кверху, ставят на лист белой бумаги и с него убирают стеклянную пластинку (если это пробирка, то вместо пластинки можно использовать палец). Учащиеся наблюдают, как газ в цилиндре постепенно окрашивается в бурый цвет.
Рис. 32. Прибор для получения оксида азота (II)
Учитель уточняет, что химическая реакция между медью и азотной кислотой будет рассмотрена немного позднее на этом же уроке.
Взаимодействие оксида азота (IV) с водой. В сосуд с NO2 приливают немного воды, содержимое взбалтывают и испытывают лакмусом — он краснеет из-за образовавшихся в результате двух кислот:
![]()
Учитель подчеркивает, что с. о. азота в NO2 равна +4, т. е. является как бы промежуточной между +3 и +5, поэтому этому оксиду соответствуют сразу две кислоты — азотистая и азотная.
Если же растворение NO2 в Н2O проводить в присутствии кислорода, то образуется только азотная кислота:
![]()
II. Разложение азотной кислоты и ее свойства как электролита
Учитель просит учащихся дать характеристику азотной кислоты по всем известным им признакам классификации этого класса соединений: одноосновная, кислородная, растворимая, сильная (α → 1), летучая, непрочная. Поэтому при стоянии она разлагается и бывает окрашена в желтоватый цвет из-за образовавшегося при этом NO2:
![]()
Чтобы доказать образование кислорода при разложении азотной кислоты, учитель проводит демонстрационный опыт.
В лапке штатива вертикально закрепляют пробирку, на 1/4 объема ее приливают концентрированную азотную кислоту. Пробирку слегка подогревают и в нее вносят тлеющую лучинку так, чтобы конец ее был максимально приближен к поверхности кислоты. Лучинка вспыхивает.
Еще эффектнее проходит демонстрация воспламенения капельки скипидара в подогретой концентрированной кислоте.
Как сильный электролит, азотная кислота взаимодействует с основаниями, основными оксидами, с солями.
Для экономии времени учитель проводит демонстрацию (лабораторная работа проводится учащимися при 3 ч в неделю) взаимодействия избытка HNO3 с подкрашенным фенолфталеином раствором щелочи, растворения свежеполученного осадка Сu(ОН)2 при приливании к нему раствора азотной кислоты, взаимодействия раствора Na2CO3 и мрамора с HNO3 и просит учащихся дома записать уравнение проделанных реакций в ионной и молекулярной формах (именно в этом порядке!).
III. Окислительные свойства азотной кислоты
Окислительные свойства HNO3 учитель рассматривает с учащимися по аналогии со свойствами H2SO4 (конц.): окислителем будет не Н+, а нитрат-ион (точнее, ![]() ). Но, в отличие от серной кислоты, у которой окислительные свойства образованных ею ионов определялись ее концентрацией, у азотной кислоты при любой концентрации окислительные свойства Н+ не проявляются. Поэтому, например, при взаимодействии с металлами HNO3 любой концентрации не выделяется Н2, а образуются продукты восстановления нитрат-иона NO3-.
). Но, в отличие от серной кислоты, у которой окислительные свойства образованных ею ионов определялись ее концентрацией, у азотной кислоты при любой концентрации окислительные свойства Н+ не проявляются. Поэтому, например, при взаимодействии с металлами HNO3 любой концентрации не выделяется Н2, а образуются продукты восстановления нитрат-иона NO3-.
Учитель напоминает о проделанном в начале урока опыте взаимодействия HNO3 (разб.) с медью, просит ребят записать уравнение этой реакции и расставить в ней коэффициенты с помощью метода электронного баланса:
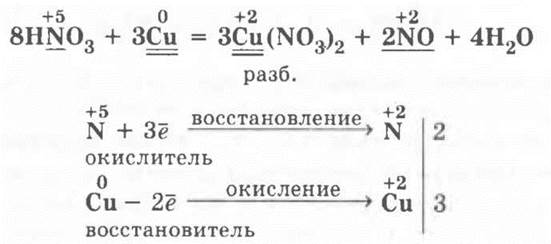
Затем показывает опыт — взаимодействие концентрированной азотной кислоты с медью. Очень эффектна демонстрация с порошком меди или мелко нарезанными кусочками тоненькой медной проволоки: в пробирку с 3—4 мл концентрированной азотной кислоты аккуратно с помощью стеклянной трубочки, чтобы не измазать стенки пробирки, насыпают немного порошка меди или бросают несколько кусочков проволоки.
Реакция идет без нагревания и сопровождается великолепным цветовым эффектом: раствор в пробирке становится изумрудно-зеленым, а пробирка над поверхностью раствора заполняется красно-бурым газом:

Для того чтобы показать, что HNO3 является сильным окислителем не только по отношению к металлам, но и к другим веществам, учитель напоминает о том, как вспыхивал при взаимодействии с ней скипидар. Он также может продемонстрировать окисление индиго.
В пробирку приливается немного синего раствора индиго и добавляется несколько капель концентрированной азотной кислоты. Происходит обесцвечивание раствора.
Можно упомянуть и о «царской водке» — смеси НСl и HNO3 (3:1), которая способна растворять золото:
![]()
IV. Получение азотной кислоты
В лаборатории азотную кислоту получают действием на нитраты концентрированной серной кислоты:
![]()
Пары азотной кислоты отводятся в сосуд, погруженный в снег, холодную воду со льдом или другой охладительной смесью, где они и конденсируются в жидкость (рис. 33).
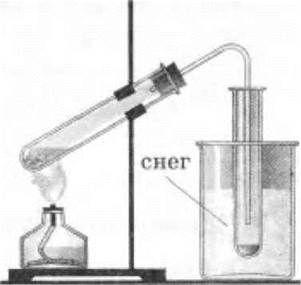
Рис. 33. Получение азотной кислоты действием серной кислоты на нитрат натрия или калия
В промышленности HNO3 получают двумя способами:
1. Электродуговым — из N2.
2. Аммиачным — из NH3.
Химизм процессов ребятам знаком:
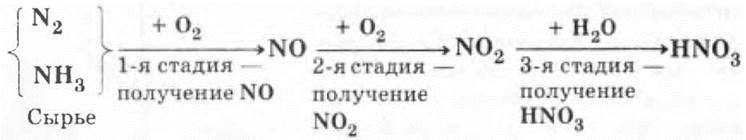
V. Применение азотной кислоты
Азотную кислоту используют для производства:
• азотных удобрений и в первую очередь аммиачной селитры (как ее получают?);
• взрывчатых веществ (почему?);
• красителей;
• нитратов, о которых пойдет речь на следующем уроке.