Настольная книга учителя по химии 9 класс - поурочные разработки
Общая характеристика щелочных металлов - Металлы
Цели урока. Дать общую характеристику щелочных металлов в свете общего, особенного и единичного по трем формам существования химических элементов: атомов, простых веществ и сложных веществ. На химии элементов этой группы повторить основные закономерности изменения свойств элементов в Периодической системе по вертикали (в группе), металлическую связь и металлическую кристаллическую решетку, физические и химические свойства металлов, свойства основных оксидов и щелочей и т. д.
Оборудование и реактивы. Образцы щелочных металлов (Li, Na, К); MnO2; НСl (конц.); чашечки Петри, вода, фенолфталеин, кодоскоп; колбы с кислородом, закрытые пробками; ложечки для сжигания веществ.
I. Строение атомов элементов главной подгруппы I группы
При анализе этой характеристики атомов учащиеся подчеркивают общие закономерности в строении атомов щелочных металлов: сходство внешнего электронного слоя, последовательное изменение атомных радиусов, увеличение числа электронных слоев в атоме.
Следствием данного анализа является вывод о некоторых закономерностях в проявлении свойств химических элементов главной подгруппы I группы. Поскольку на внешнем электронном слое атомов этих элементов есть один электрон, то они являются очень сильными восстановителями и проявляют в соединениях постоянную степень окисления +1. В подгруппе от Li к Csрадиусы атомов увеличиваются, так как возрастает число электронных слоев. Поэтому увеличиваются и восстановительные свойства металлов от Li к Cs.
II. Щелочные металлы — простые вещества
При обобщении знаний о физических свойствах щелочных металлов учитель обращает внимание учащихся на повторение основных сведений о металлической связи и металлической кристаллической решетке на конкретных примерах. Учащиеся записывают обобщенную схему возникновения металлической связи для этих металлов:
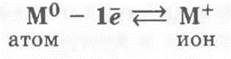
Учащиеся в ходе демонстрации им учителем образцов щелочных металлов сами делают обобщение, что все они при обычных условиях мягкие, серебристо-белые вещества, прекрасные проводники электричества. Температуры их плавления и кипения, подчеркивает уже учитель, уменьшаются с увеличением порядкового номера элемента. Плотность же их, наоборот, как правило, возрастает от Li к Cs (правда, есть и отступление от этого правила — у Na плотность больше, чем у Li и К). Li, Na, К легче воды.
Все щелочные металлы, кроме Li, плавятся при температуре ниже температуры кипения воды.
III. Химические свойства щелочных металлов
В химических реакциях щелочные металлы проявляют ярко выраженные восстановительные свойства, возрастающие в ряду Li — Na — К — Rb — Cs.
1. Щелочные металлы легко окисляются кислородом воздуха, поэтому их хранят под керосином. Такой вывод выражает обобщенное свойство щелочных металлов, но в то же время обращается внимание на особенное и единичное в характеристике физических свойств отдельных представителей подгруппы. Так, учитель отмечает, что Li чрезвычайно легок (почти в два раза легче воды). Он в керосине всплывает, что и затрудняет его хранение в этом нефтепродукте. В отличие от остальных металлов Li хранится в вазелине.
Кроме единичного для Li в его физических свойствах будет хорошо, если учитель подчеркнет единичное и для химических свойств этого вещества. Так, учитель отмечает, что при сгорании в кислороде щелочных металлов могут образоваться бинарные соединения различного состава — пероксиды, надпероксиды (последние запоминать не нужно), и демонстрирует горение Li и Na в колбах с кислородом (см. описание опытов в уроках «Общие свойства металлов»). При этом литий образует нормальный основный оксид Li2O, а натрий — пероксид Na2O2. Учитель подчеркивает, что во всех случаях на связь с кислородом атом щелочного металла расходует один электрон.
2. Щелочные металлы взаимодействуют с другими окислителями — галогенами, серой, фосфором, образуя при этом соли:

Эти реакции рассматриваются как окислительно-восстановительные.
Для демонстрации горения натрия в хлоре можно использовать простейшую установку (рис. 15).
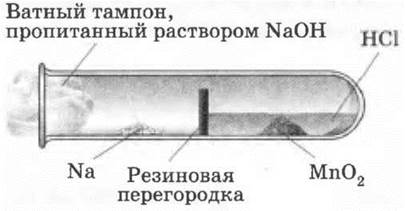
Рис. 15. Прибор для демонстрации горения натрия в хлоре
Пробирку делят на два отдела, вставляя в нее на х/3 срезанный кружок из резиновой пробки толщиной около 1 см, как указано на рисунке. В первый отдел при помощи лучинки или полоски толстой бумаги насыпают 1—2 г диоксида марганца и пипеткой наливают около 1 мл концентрированной соляной кислоты. Во второй отдел кладут металлический натрий и пробирку закрывают ватным тампоном, смоченным раствором едкого натра. Сначала до плавления нагревают натрий, затем первый отдел, чтобы выделялся хлор. В токе хлора горит натрий.
Ранее было дано описание эффектной демонстрации взаимодействия натрия с серой.
3. При нагревании в струе водорода щелочные металлы образуют твердые солеобразные вещества ионного типа — гидриды:
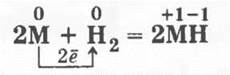
Учитель отмечает, что степень окисления водорода в гидридах щелочных металлов равна -1.
4. Простые вещества — металлы окисляются молекулами воды, образуя при этом щелочи (отсюда и название подгруппы):
![]()
Здесь уместно рассмотреть зависимость скорости химической реакции от природы реагирующих веществ. Так, скорость реакции взаимодействия лития с водой меньше, чем натрия, и еще меньше, чем калия. Взаимодействие рубидия и цезия с водой протекает так быстро, что происходит взрыв.
Для демонстрации зависимости скорости химической реакции от природы щелочного металла можно для эффектного показа использовать кодоскоп, на который помещаются чашечки Петри, подписанные снизу маркерами (Li, Na), с водой (очень немного, буквально пленочка воды с несколькими каплями фенолфталеина). В них помещаются кусочки Li и Na величиной с горошину. Демонстрация очень наглядна и эффектна.
В заключение этой части урока учитель уточняет, почему не принято записывать уравнения реакций щелочных металлов с растворами кислот и солей (так как они взаимодействуют с водой).
IV. Соединения щелочных металлов
1. Оксиды щелочных металлов с общей формулой М2O, полученные прямо или косвенно, — твердые кристаллические вещества, обладающие всеми характерными свойствами основных оксидов. Учащиеся повторяют эти свойства и записывают уравнения соответствующих реакций в обобщенной или конкретизированной для какого-либо оксида форме. Уравнения реакций с кислотами записывают также и в ионной форме.
2. Гидроксиды щелочных металлов — с общей формулой МОН — твердые кристаллические вещества с ионной кристаллической решеткой, хорошо растворяются в воде. Энергия гидратации превышает энергию ионизации. Поэтому при растворении гидроксидов выделяется много тепла. Растворимость их, степень электролитической диссоциации, а следовательно, и щелочные свойства усиливаются в ряду
LiOH — NaOH — КОН — RbOH — CsOH
Эти вещества обладают всеми типичными свойствами оснований. Учащиеся рассматривают их в свете представлений об электролитической диссоциации и записывают соответствующие уравнения реакций в молекулярной и ионной формах.
Распознавание ионов щелочных металлов по окраске пламени — это очень простая демонстрация. Она проводится в фарфоровых чашечках, в которые помещается соль щелочного металла и летучей кислоты (Na2CO3, Li2CO3, К2СO3). Затем в чашечку приливают раствор кислоты (НСl, H2SO4 или HNO3) и в нее направляется язычок пламени — оно и будет окрашиваться в соответствующий цвет, так как бурно выделяющийся газ захватывает с собой ионы металла, которые и придают окраску пламени.
Можно просто высыпать на пламя горелки или спиртовки немного кристаллической соли с таким же эффектом. В этом случае лучше использовать нитраты соответствующих металлов.
Ионы Na+ окрашивают пламя в желтый цвет.
Ионы К+ — в фиолетовый цвет. Однако в присутствии даже небольшого количества соединений натрия фиолетовый цвет маскируется желтым. В этом случае его можно заметить через синее стекло, поглощающее желтые лучи.
Ионы Li+ окрашивают пламя в красный (малиновый) цвет.
V. Природные соединения, получение и применение щелочных металлов и их соединений
Учащиеся самостоятельно делают вывод о том, что щелочные металлы в силу своей активности встречаются в природе только в виде соединений: хлоридов, сульфидов, карбонатов и др. Обладая ярко выраженными восстановительными свойствами, они не могут быть получены восстановлением из этих соединений ни углем, ни оксидом углерода (II), ни водородом, а только наиболее сильным из восстановителей — электрическим током.
В заключение урока предлагаем учащимся проделать лабораторные опыты по распознаванию соединений щелочных металлов.
Области применения щелочных металлов и их важнейших соединений учащиеся разбирают самостоятельно дома.